免疫疗法已经改变了治疗癌症的范例,这些疗法旨在提高抗肿瘤免疫反应,以通过自然机制攻击癌细胞,减少脱靶(off-target)效应,有别于化疗和其他直接杀死癌细胞的药物。因此被认为是一种治疗甚至治愈某些类型癌症的有前景的策略。
近日,宾夕法尼亚大学的CAR-T大牛Carl H. June作为作者之一,在Nature Reviews Drug Discovery探讨了癌症免疫疗法存在的挑战,以及可能促使其更安全有效的新型递送策略。
癌症免疫疗法的分类
第一种商业化的癌症免疫疗法是细胞因子干扰素-α(IFNα)的重组形式,其在1986年被美国食品和药物管理局(FDA)批准用于毛细胞白血病。一些接受治疗的患者在早期临床试验中经历了部分缓解,但由于IFNα的治疗持续时间短,很快被嘌呤类似物替代为毛细胞白血病的一线治疗药物。
此后不久,重组白细胞介素-2(IL-2)作为癌症免疫疗法被研究,并于1992年被FDA批准用于转移性肾癌,1998年被批准用于转移性黑素瘤。 最初,人们对IL-2治疗拥有极大的热情,因为它的使用促使了一些患者的持久完全反应。然而,由于IL-2的半衰期短,需要高剂量,这导致严重的副作用,包括细胞因子释放综合征和血管渗漏综合征等。
尽管这些疗法的早期临床研究很有希望,但在21世纪初,癌症免疫治疗领域的进展停滞不前,这在很大程度上归因于许多疫苗临床试验的失败。
第一次成功的治疗性癌症疫苗,sipuleucel-T(一种自体树突状细胞疗法),于2010年被FDA批准用于前列腺癌,但其临床转化受到生产复杂性和其他问题的阻碍。
此后不久,先驱检查点抑制剂ipilimumab,一种靶向细胞毒性T淋巴细胞抗原4(CTLA4)的单克隆抗体(mAb),于2011年被批准用于晚期黑色素瘤。
在过去几年中,新的免疫疗法 - 包括针对程序性细胞死亡蛋白1(PD-1)或其配体PD-L1的其他检查点抑制剂mAb,以及第一个嵌合抗原受体(CAR)T细胞疗法 - 已经开发并批准用于临床。ipilimumab和CAR-T细胞疗法的出现是癌症免疫疗法的一个转折点,权威期刊Science强调了癌症免疫疗法是2013年十大科学突破的榜首。
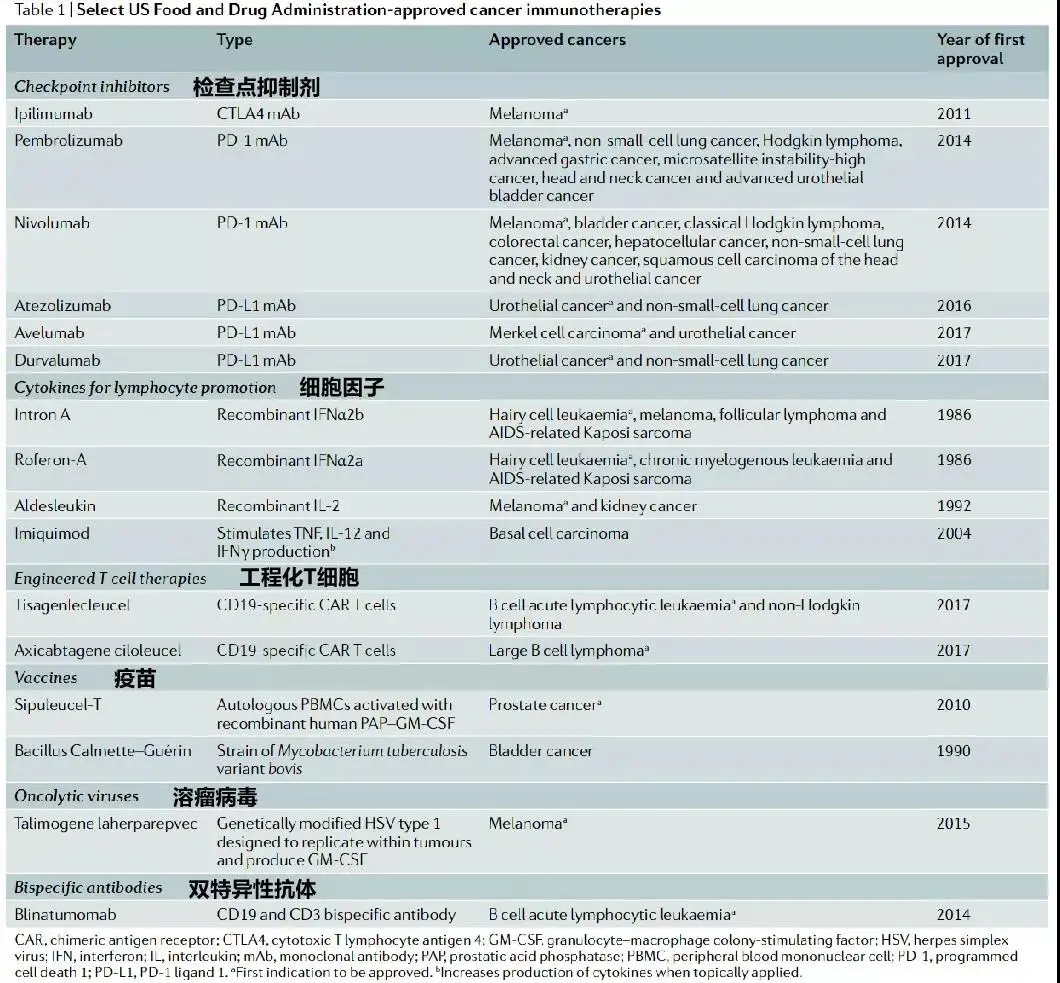
目前有十几种免疫疗法被批准用于癌症治疗,还有更多的免疫疗法正在进行临床试验。这些免疫疗法分为几类,包括检查点抑制剂、淋巴细胞活化细胞因子、CAR-T细胞和其他细胞疗法、抗共刺激受体的激动性抗体、癌症疫苗、溶瘤病毒和双特异性抗体。
部分FDA批准的癌症免疫疗法(图片来源:Nature Reviews Drug Discovery)
疗效与安全性的挑战
尽管取得了这些重大进展,但免疫疗法的临床应用仍面临着与疗效和安全性相关的若干挑战。以更安全,更可控的方式施用癌症免疫疗法,可以将治疗潜力扩展到更广泛的患者群体,并且还可以减少毒性。特别地,改进的递送技术可以增加病变组织内免疫疗法的积累,使得能够更有效地靶向期望的肿瘤和/或免疫细胞,并减少脱靶的副作用。
就疗效而言,只有部分患者对免疫治疗有反应,并且很难预测。
由此,人们热衷于对开发基于癌细胞生物标志物表达的患者特异性免疫疗法以及评估联合治疗策略以提高反应率。
许多实体肿瘤中的微环境对所有免疫治疗类别的广泛实施提出了挑战。例如,实体瘤的微环境可分为免疫学上的“热”(高免疫原性)或“冷”(低免疫原性),它们分别在肿瘤空间内具有高或低水平的细胞毒性淋巴细胞浸润。微环境组成的这一关键差异表明,具有高免疫原性的肿瘤对检查点抑制剂的反应强于免疫原性低的肿瘤。因此,可以利用递送技术来调节冷肿瘤中的免疫原性。
近几年,几种免疫疗法,包括用于检查点封锁的活化细胞因子和单克隆抗体,已被FDA批准用于实体瘤治疗。值得注意的是,CAR-T细胞疗法尚未被FDA批准用于实体肿瘤,但研究人员正在开发对实体肿瘤细胞具有高度特异性的CAR-T细胞。
就安全性而言,免疫疗法可以诱导自身免疫副作用,导致对健康组织的攻击。
检查点抑制剂、细胞因子和激动性抗体具有类似的递送挑战。这些疗法的成功依赖于它们与靶蛋白的相互作用。其使用的一个主要障碍是产生大量的自身免疫力,限制允许给药剂量。许多免疫疗法引起细胞因子释放综合征和血管渗漏综合征,导致严重的低血压、发热、肾功能不全和其他潜在致命的不良反应。
出于这个原因,这些疗法的递送技术应实现靶向和控制释放,限制药物暴露于特定组织来降低免疫疗法的全身毒性,最小化脱靶效应。
新型递送平台
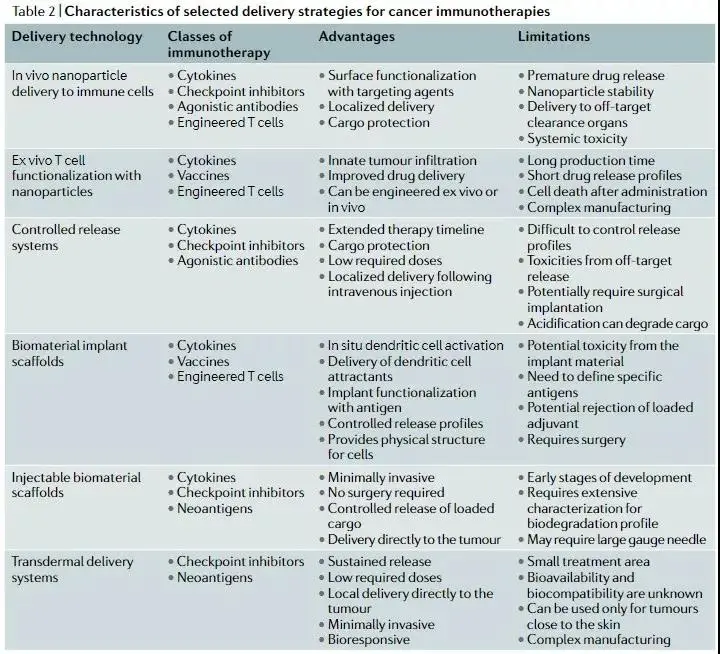
目前,正在开发用于免疫疗法的新型递送平台,包括纳米颗粒、植入物、支架、生物材料和基于细胞的平台。一些材料,包括脂类、聚合物和金属,已被利用来开发递送技术。与单独的治疗药物相比,递送平台提供了许多益处:
首先,它们可以设计成保护治疗性货物,直到被输送到靶细胞;
其次,如果递送系统响应于诸如pH、光或超声波的刺激,则递送系统可以实现对治疗的时空控制,从而保持货物无活性直至其积聚在靶细胞内;
最后,诸如植入物的递送平台用已经开发用于药物的局部化、受控递送,并且已经开发了细胞疗法以最小化与全身给药相关的毒性。
癌症免疫疗法递送策略的特征(图片来源:Nature Reviews Drug Discovery)
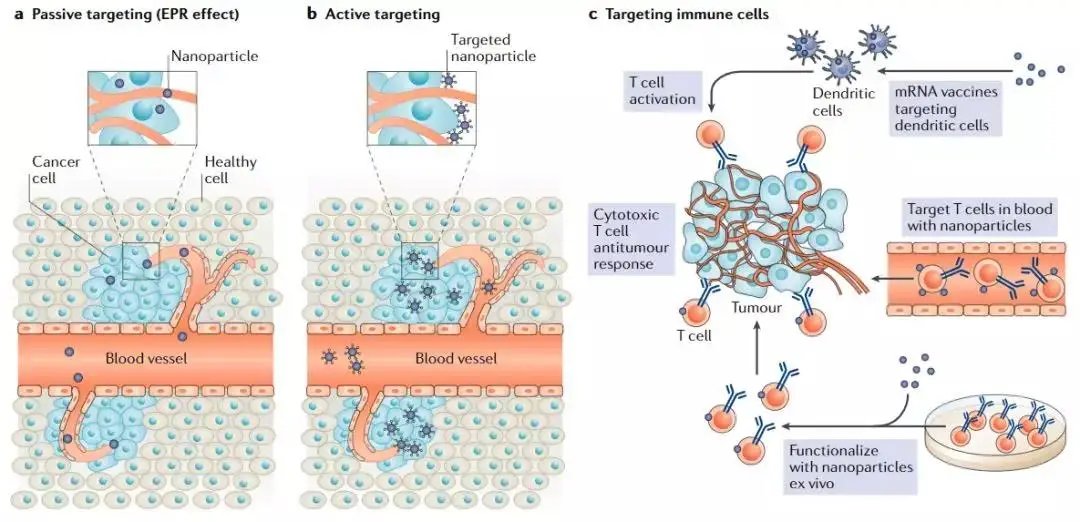
几十年来,人们一直认为向肿瘤选择性纳米药物可以利用高通透性和滞留(enhanced permeability and retention, EPR)效应 - 其特征在于肿瘤血管比正常血管对大分子的渗透性更强,并且由于淋巴清除不良导致大分子的保留。尽管EPR效应在实体肿瘤的临床前模型中显著,其表现出渗漏的脉管系统并且也在人类中观察到,但仍然不清楚它在癌症患者中的治疗潜力,并且在临床试验中研究的大多数纳米治疗剂未显示出超过常规化疗的实质性益处。
一项对117项纳米医学递送的研究进行的荟萃分析显示(其中一些研究依赖于EPR效应或癌细胞的主动靶向),表明只有0.7%(中位数)的纳米颗粒到达肿瘤。磁共振成像(MRI)或正电子发射断层扫描(PET)研究评估EPR效应在肿瘤中的作用揭示了患者之间、个体患者肿瘤之间的实体肿瘤通透性的高度可变性。这些发现证明理解肿瘤的物理微环境及其渗透性的重要性,有助于最佳地设计用于肿瘤穿透和摄取的递送系统。
癌症纳米医学的范例(图片来源:Nature Reviews Drug Discovery)
不同的给药途径可以影响递送技术的治疗功效。例如,使用肿瘤内注射或可植入支架的局部递送可导致肿瘤中药物的更高积累,但对于不易接近的肿瘤可能不可行。因此,在评估特定类型癌症的免疫疗法的递送技术时,给药途径是重要的考虑因素。
目前,还在探索局部递送技术,例如可注射水凝胶、可植入生物材料和微针等。
基于纳米颗粒的免疫疗法递送至血液中的肿瘤浸润性免疫细胞,而不是直接靶向肿瘤细胞,是改善肿瘤中免疫治疗定位和刺激抗肿瘤反应的潜在有吸引力的手段。
利用在脉管系统内发生的受体-配体相互作用将基于免疫治疗剂递送至内源性免疫细胞,然后内源性免疫细胞可以迁移到肿瘤中以递送治疗剂。
mRNA疫苗是用于癌症免疫疗法的有希望的平台,然而,其应用受到不稳定性和低效的体内mRNA递送的限制;阳离子脂质纳米颗粒候选物已经在黑色素瘤患者中显示有希望的免疫反应。
虽然利用阳离子脂质的方法具有很好的效果,但它们既有毒又有免疫原性,为了克服阳离子脂质用于基于mRNA的免疫疗法所面临的挑战,可电离的脂质类材料已被设计成减少毒副作用,同时保持其转染特性。临床前研究显示,可电离脂质纳米颗粒可以改善mRNA疫苗的传递并诱导强大的免疫反应。
虽然免疫调节抗体可以诱导强大的抗肿瘤免疫反应,但这些药物的全身递送可以诱导细胞因子释放综合征和肝功能异常。为了最大限度地减少组织外的影响,已经设计了用于体内局部和持续释放的递送系统。
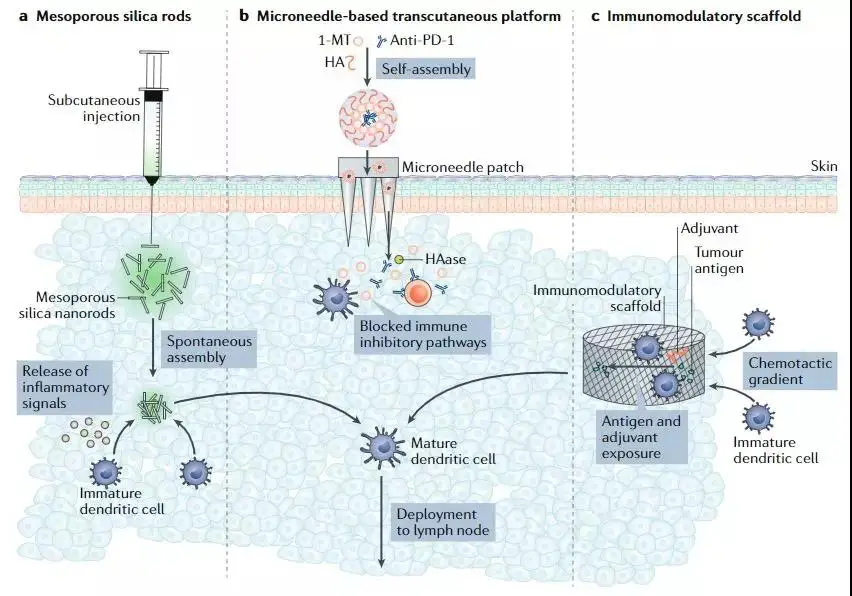
用于局部递送癌症免疫疗法的生物材料(图片来源:Nature Reviews Drug Discovery)
植入式生物材料
基于树突状细胞的疫苗,通过离体分离和激活树突细胞并将它们重新引入患者来改善对癌症的免疫应答,以便它们可以进入淋巴结并将抗原呈递给初始T细胞,随后扩增并引发抗肿瘤反应。然而,这些疫苗需要在体外对细胞进行复杂的修饰,大多数注射的细胞在移植后死亡。
为了克服这个问题,植入式生物材料已经被用于癌症治疗,它提供了一种物理结构来吸引树突状细胞进行原位免疫治疗。在这些系统中,聚合物支架用作药物递送装置,控制生物活性分子在空间和时间的递送以募集树突状细胞并诱导其增殖。肿瘤抗原也可以固定在这些基质上,使它们能够作为抗原呈递结构,其中树突细胞被募集、激活,负载抗原并被释放。
可注射支架
植入式支架需要用到侵入性外科手术,这提出了后勤挑战。
因此,还设计了无需手术植入、可以通过注射给药的支架,例如藻酸盐水凝胶,明胶和中孔多孔二氧化硅微粒的材料,以产生局部免疫原性环境,在体内募集、激活和释放免疫细胞。这些材料都是高度可变形和自组织。尽管该策略避免了与手术植入相关的风险,但注射材料的生物降解和安全性将有待进一步研究。
可注射水凝胶
作为二氧化硅的可生物降解替代品,已经设计了可注射的原位形成水凝胶,以局部递送免疫疗法和化学疗法的组合。
在一项研究中,可注射聚(乙烯醇)(PVA)水凝胶网络被设计为响应于活性氧物质,这些物质在肿瘤微环境中高水平存在。预计该策略可以改善具有低免疫原性的癌症的治疗结果。此外,该技术可以避免与全身施用的检查点抑制剂或化学疗法相关的毒副作用。
基于微针的透皮给药
虽然已经批准了针对CTLA4或PD-1的全身给药的检查点抑制剂用于治疗黑素瘤,但是相当大比例的患者对治疗没有反应。例如,对抗PD-1 mAb nivolumab的客观反应率约40%。
微创透皮递送系统能够以受控方式直接在疾病部位持续释放抗PD-1mAb,从而最小化所需剂量。这些传递系统由可降解的微针贴片组成,可以无痛地穿透皮肤到达富含免疫细胞的表皮,以提供免疫治疗。
微针通常由可生物降解的聚合物(如透明质酸)构成,并且装有含有抗-PD-1的pH敏感纳米颗粒。在温和的酸性肿瘤微环境中,pH敏感的抗PD-1纳米颗粒释放以局部激活免疫系统以攻击癌细胞。
基于微针的透皮给药系统为局部免疫治疗提供了高度模块化的方法,利用生物和远程触发的刺激来控制药物释放。下一步,研究还需评估贴剂内治疗剂的生物利用度以及递送系统的生物相容性。
T细胞疗法递送技术(图片来源:Nature Reviews Drug Discovery)
治疗佐剂的递送
过继性T细胞疗法的主要限制是移植细胞的活力和功能在施用后迅速下降。因此,这种基于细胞的疗法需要同时施用佐剂药物以最大化细胞的功效和性能。然而,这些药物需要以高剂量全身给药,导致许多毒副作用。
为了克服这些障碍,现在正在探索由纳米颗粒、支架或两者的组合组成的递送技术。例如,载有治疗佐剂的纳米颗粒,其与供体T细胞的表面化学缀合,作为刺激移植细胞和最小化全身副作用的手段。这种方法高度模块化,适用于提供一系列免疫刺激药物,并实现长期释放。
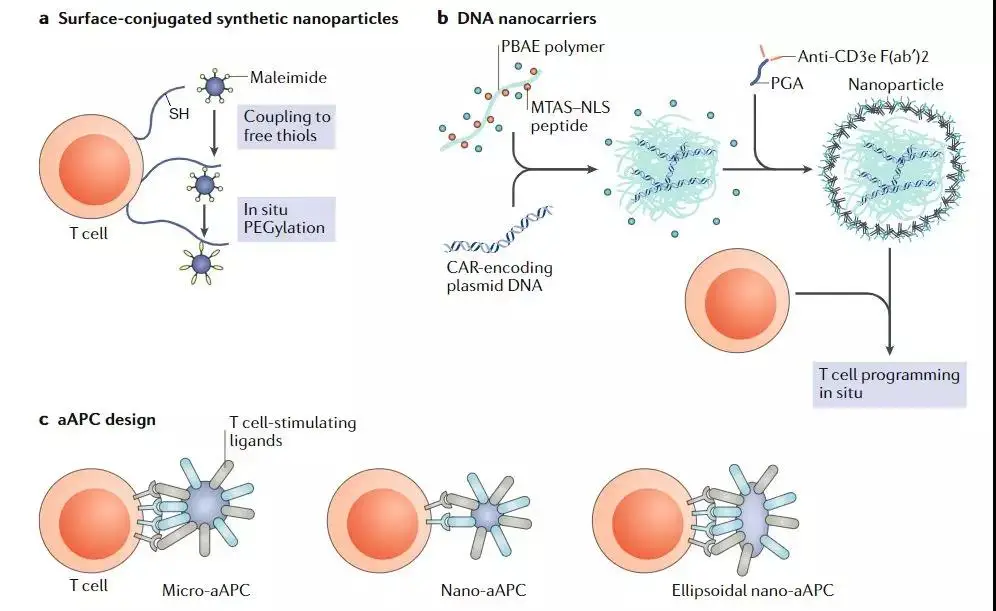
通过DNA纳米载体进行原位T细胞工程
为了克服在体外产生大量过继性T细胞所需的复杂程序和高成本,正在开发用于原位工程T细胞的递送技术。
作为体外基因工程的替代品,纳米颗粒平台被设计用于重新编程循环中的T细胞。该平台被设计成靶向并进入小鼠血流中的T细胞,然后将CAR基因递送到T细胞核中。利用基于聚(β-氨基酯)(PBAE)的纳米颗粒将DNA货物递送到T细胞的细胞核中,并且进一步用含有微管相关序列和核定位信号的肽进行功能化,以促进CAR编码DNA的核输入。
在临床前模型中,该平台的功效与传统的过继性T细胞疗法相当,没有观察到动物存活的实质差异。选择性地,使用纳米颗粒原位工程T细胞可以提供一种实用且低成本的方法,可直接在患者体内设计CAR-T细胞来治疗癌症。未来的研究将需要解决体内编程CAR-T细胞的成本益处是否会超过对无意基因转移的潜在安全性担忧。
基于生物材料的植入物
除了全身性给药途径外,还研究了基于生物材料的策略,以便将过继性T细胞局部递送至实体肿瘤。
虽然过继性T细胞疗法已经为几种类型的癌症(包括黑色素瘤和血液系统恶性肿瘤)产生了有希望的结果,但成功将T细胞靶向大多数实体癌症仍然具有挑战性。这些疗法部分地受到T细胞向肿瘤的低效迁移和免疫抑制性肿瘤微环境中的T细胞扩增缺失的影响。
因此,局部递送T细胞至肿瘤微环境并增加其增殖的技术,将有望增强免疫疗法在实体瘤中的疗效。最近,已经研究了聚合物支架用于将T细胞局部递送至肿瘤微环境。除了在肿瘤部位或肿瘤部位附近定位T细胞外,聚合物支架也是有利的,因为它们可以作为储库,当材料降解时,T细胞被释放。
合成的人工抗原呈递细胞(aAPC)
合成的人工抗原呈递细胞(aAPC)是细胞样颗粒,T细胞刺激分子与其表面结合,以模拟APC。所得到的信号转导激活T细胞并触发抗肿瘤反应。
与基于细胞的方法相比,aAPC易于生产,并且可以用各种抗原和表面配体稳定地储存和功能化,用于可调节的免疫疗法。 aAPC通常由细胞鳞片(2-10μm)球形颗粒组成,主要包括脂质、磁性分子或聚合物。虽然这样的aAPC可以在体外激活T细胞,但由于生物利用度差和大尺寸,使用这种方法体内激活T细胞仍然具有挑战性。
为了实现体内分离,最近设计了纳米级aAPC。
总的来说,合成的aAPC递送系统通过在合成颗粒的表面上同时呈递多个信号以活化体内T细胞,提供了对传统过继性T细胞疗法的潜在替代方案。这些系统的未来迭代应评估其他物理化学性质的作用,例如颗粒刚性和脂质膜流动性,以进一步优化aAPC-T细胞相互作用。
■ ■ ■
为克服免疫疗法临床转化所面临的挑战,开发的新型递送平台具有必要性。如何设计以更好地提高免疫疗法的有效性和安全性,并最终改善患者预后,将是这些递送技术应用于癌症免疫疗法的核心。
- 癌症免疫疗法的新型递送平台
免疫疗法已经改变了治疗癌症的范例,这些疗法旨在提高抗肿瘤免疫反应,以通过自然机制攻击癌细胞,减少脱靶(of......
- 涨姿势:肿瘤生物治疗
- CAR-NK:癌症免疫疗法“新星”冉冉升起